Szpik kostny to gąbczasta tkanka wewnątrz niektórych kości ciała, w tym kości biodrowych i udowych. Zawiera niedojrzałe komórki, zwane komórkami macierzystymi.
Wiele osób z rakiem krwi, takimi jak białaczka czy chłoniak, oraz z niedokrwistością sierpowatokrwinkową i innymi groźnymi chorobami, polega na przeszczepach szpiku kostnego lub krwi pępowinowej, aby przeżyć.
Aby żyć, potrzebny jest zdrowy szpik kostny oraz komórki krwi. Kiedy choroba wpływa na szpik kostny w taki sposób, że nie może już działać skutecznie, najlepszym sposobem leczenia może być przeszczep szpiku lub krwi pępowinowej; dla niektórych pacjentów jest to jedyne potencjalne lekarstwo.
Szybkie fakty dotyczące szpiku kostnego
Oto kilka kluczowych punktów dotyczących szpiku kostnego. Więcej szczegółów znajduje się w głównym artykule.
- Szpik kostny produkuje 200 miliardów nowych czerwonych krwinek każdego dnia, wraz z białymi krwinkami i płytkami krwi.
- Szpik kostny zawiera mezenchymalne i hematopoetyczne komórki macierzyste.
- Około 10 000 osób w Stanach Zjednoczonych każdego roku diagnozuje się chorobami wymagającymi przeszczepu szpiku kostnego.
- Kilka chorób stanowi zagrożenie dla szpiku kostnego i zapobiega przekształcaniu szpiku kostnego w komórki podstawowe.
Czym jest szpik kostny?
Szpik kostny jest miękką, żelatynową tkanką wypełniającą jamę szpikową, środek kości. Dwa typy szpiku kostnego to czerwony szpik kostny, znany jako tkanka szpikowa, oraz żółty szpik kostny, który jest tłuszczowy.
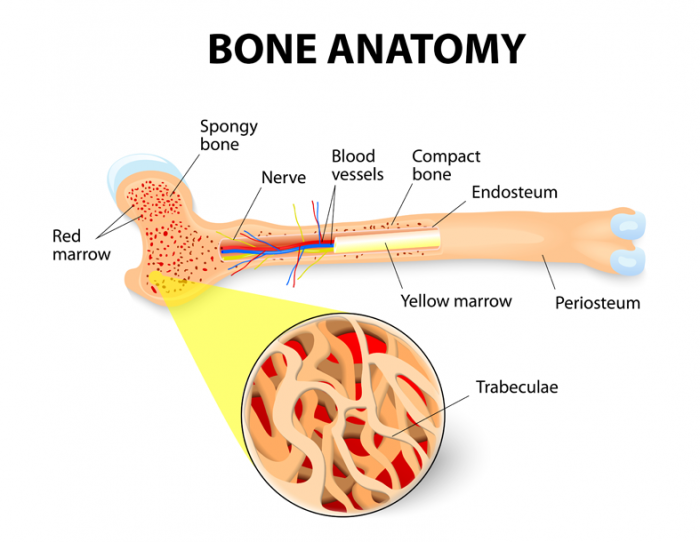
Oba typy szpiku kostnego są dobrze ukrwione i zawierają naczynia włosowate.
Szpik kostny wytwarza codziennie ponad 200 miliardów nowych komórek krwi. Większość komórek krwi w organizmie rozwija się z komórek w szpiku kostnym.
Komórki macierzyste szpiku kostnego
Szpik kostny zawiera dwa typy komórek macierzystych: mezenchymalne oraz hematopoetyczne.
Czerwony szpik kostny składa się z delikatnej, wysoce naczyniowej tkanki włóknistej zawierającej hematopoetyczne komórki macierzyste, które są krwiotwórczymi komórkami macierzystymi.
Żółty szpik kostny zawiera mezenchymalne komórki macierzyste, znane również jako komórki zrębowe szpiku. Te produkują tłuszcz, chrząstki i kości.
Komórki macierzyste to niedojrzałe komórki, które mogą przekształcić się w wiele różnych typów komórek.
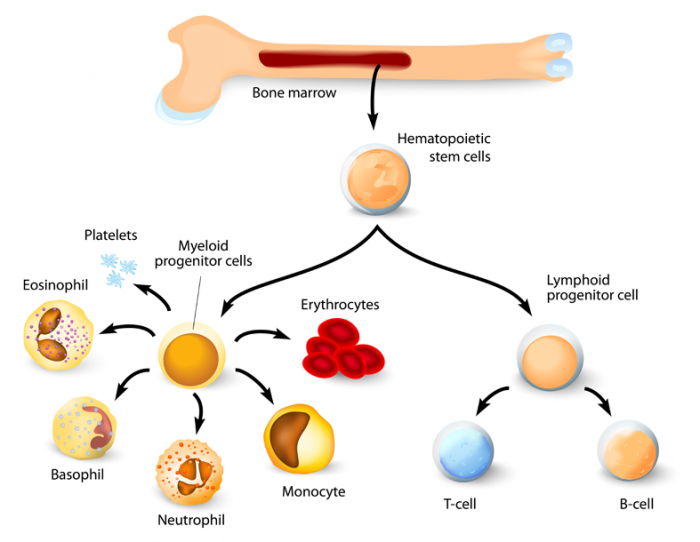
Hematopoetyczne komórki macierzyste w szpiku kostnym prowadzą do powstania dwóch głównych typów komórek: linii mieloidalnej i limfoidalnej. Należą do nich monocyty, makrofagi, neutrofile, bazofile, eozynofile, erytrocyty, komórki dendrytyczne oraz megakariocyty (płytki krwi), a także komórki T i B oraz komórki NK.
Różne typy hematopoetycznych komórek macierzystych różnią się zdolnością do regeneracji i potencjałem.
Niektóre z nich są multipotentne, oligopotentne lub unipotentne, w zależności od tego, ile typów komórek mogą utworzyć.
Pluripotencjalne hematopoetyczne komórki macierzyste mają następujące właściwości:
- Odnowienie: Mogą odtworzyć inną komórkę identyczną z samą sobą.
- Różnicowanie: Mogą generować jeden lub więcej podzbiorów bardziej dojrzałych komórek.
Proces rozwoju różnych krwinek z tych pluripotencjalnych komórek macierzystych nazywa się hematopoezą.
To właśnie te komórki macierzyste są potrzebne w transplantacji szpiku kostnego.
Komórki macierzyste nieustannie dzielą się i wytwarzają nowe komórki. Niektóre nowe komórki pozostają jako komórki macierzyste, a inne przechodzą serię etapów dojrzewania jako komórki prekursorowe lub komórki blastyczne, zanim uformują się jako dojrzałe komórki krwi. Komórki macierzyste szybko się namnażają, aby codziennie wytwarzać miliony komórek krwi.
Komórki krwi mają ograniczoną długość życia, wynoszącą około 100-120 dni dla erytrocytów. Muszą być stale wymieniane. Ważne jest więc wytwarzanie zdrowych komórek macierzystych.
Naczynia krwionośne działają jak bariera uniemożliwiająca niedojrzałym krwinkom opuszczanie szpiku kostnego.
Tylko dojrzałe komórki krwi zawierają białka błonowe wymagane do przyłączenia się i przechodzenia przez śródbłonek naczynia krwionośnego. Hematopoetyczne komórki macierzyste mogą jednak przekraczać barierę szpiku kostnego. Mogą być zbierane z krwi obwodowej lub krążącej krwi.
Komórki macierzyste tworzące krew w czerwonym szpiku kostnym mogą się rozmnażać i dojrzewać do trzech ważnych typów komórek krwi, każdy z własną funkcją:
- Czerwone krwinki (erytrocyty) transportują tlen w organizmie.
- Białe krwinki (leukocyty) pomagają zwalczać infekcje i choroby. Białe krwinki obejmują limfocyty – podstawowy element układu odpornościowego – oraz komórki mieloidalne, które obejmują granulocyty: neutrofile, monocyty, eozynofile i bazofile.
- Płytki krwi (trombocyty) pomagają w krzepnięciu po urazie. Płytki krwi to fragmenty cytoplazmy megakariocytów, innej komórki szpiku kostnego.
Raz dojrzałe komórki krwi przenoszą się ze szpiku do krwioobiegu, gdzie spełniają ważne funkcje niezbędne do utrzymania zdrowia organizmu.
Mezenchymalne komórki macierzyste znajdują się w jamie szpiku kostnego. Rozróżniają się na wiele linii podścieliska, takich jak:
- Chondrocyty (generacja chrząstki).
- Osteoblasty (tworzenie kości).
- Osteoklasty.
- Adipocyty (tkanka tłuszczowa).
- Miocyty (mięśnie).
- Makrofagi.
- Komórki śródbłonka.
- Fibroblasty.
Czerwony szpik kostny
Czerwony szpik kostny wytwarza wszystkie czerwone krwinki i płytki krwi u dorosłych ludzi oraz około 60 do 70 procent limfocytów. Inne limfocyty rozpoczynają swoje życie w czerwonym szpiku kostnym i stają się w pełni ukształtowane w tkankach limfatycznych, w tym grasicy, śledzionie i węzłach chłonnych.
Wraz z wątrobą i śledzioną, czerwony szpik kostny również odgrywa rolę w pozbywaniu się starych czerwonych krwinek.
Żółty szpik kostny
Żółty szpik kostny działa głównie jako magazyn tłuszczów. Pomaga zapewnić pożywienie i utrzymać prawidłowe środowisko funkcjonowania kości. Jednak w szczególnych warunkach, takich jak poważna utrata krwi lub gorączka, żółty szpik może powrócić do funkcji czerwonego szpiku.
Żółty szpik lokalizuje się w środkowych jamach kości długich i jest ogólnie otoczony warstwą czerwonego szpiku z długimi beleczkami w gąbczastej strukturze siatkowej.
Oś czasu szpiku kostnego
Przed urodzeniem najpierw rozwija się w obojczyku szpik kostny pod koniec rozwoju płodu. Aktywuje się około 3 tygodnie później. Szpik kostny przejmuje wątrobę jako główny narząd krwiotwórczy w okresie ciąży od 32 do 36 tygodni.
Szpik kostny pozostaje czerwony aż do około 7 roku życia, ponieważ zapotrzebowanie na nowe ciągłe tworzenie krwi jest wysokie. W miarę starzenia się organizmu czerwony szpik kostny stopniowo zastępowany jest żółtą tkanką tłuszczową. Dorośli mają średnio około 2,6 kg (5,7 funta) szpiku kostnego, z czego około połowa jest czerwona.
U dorosłych, najwyższe stężenie czerwonego szpiku kostnego występuje w kościach kręgów, biodrach (biodra), mostku (piersi) (żeberkach), czaszce oraz na kończynach przynasadowych i nasadowych długich kości ramienia (kości ramiennej) i nóg (kość udowa i piszczelowa). Wszystkie inne gąbczaste lub gąbczaste kości i centralne ubytki kości długich są wypełnione żółtym szpikiem.
Funkcjonowanie
Większość czerwonych krwinek, płytek krwi i większość białych krwinek powstaje w czerwonym szpiku. Żółty szpik kostny produkuje tłuszcz, chrząstki i kości.
Białe krwinki przeżywają od kilku godzin do kilku dni, płytki krwi przez około 10 dni, a krwinki czerwone przez około 120 dni. Komórki te muszą być stale zastępowane przez szpik kostny, ponieważ każda komórka krwi ma ustaloną długość życia.
Pewne warunki mogą powodować dodatkową produkcję komórek krwi. Może się tak zdarzyć, gdy zawartość tlenu w tkankach ciała jest niska, gdy występuje utrata krwi lub niedokrwistość, lub gdy liczba czerwonych krwinek spada. W takich przypadkach nerki produkują i uwalniają erytropoetynę, hormon, który pobudza szpik kostny do produkcji większej ilości czerwonych krwinek.
Szpik kostny produkuje i uwalnia więcej białych krwinek w odpowiedzi na infekcje oraz więcej płytek w odpowiedzi na krwawienie. Jeśli dana osoba doświadcza poważnej utraty krwi, żółty szpik kostny może zostać aktywowany i przekształcony w czerwony szpik kostny.
Zdrowy szpik kostny jest kluczowy dla wielu systemów i funkcji w organizmie.
Układ krążenia
Układ krążenia dotyka każdego organu i układu w ciele. Obejmuje wiele różnych komórek o różnych funkcjach. Czerwone krwinki transportują tlen do komórek i tkanek, płytki krwi są przenoszone we krwi, aby pomóc w krzepnięciu krwi po urazie, a białe krwinki są transportowane do miejsc zakażenia lub urazu.
Hemoglobina
Hemoglobina to białko w czerwonych krwinkach, które nadaje im kolor. Hemoglobina gromadzi tlen w płucach, transportuje go w krwinkach czerwonych i uwalnia tlen do tkanek, takich jak serce, mięśnie i mózg. Dwutlenek węgla (CO2), produkt odpadowy z oddychania, jest również usuwany przez hemoglobinę i kierowany z powrotem do płuc w celu wydychania.
Żelazo
Żelazo jest ważnym składnikiem odżywczym dla ludzkiej fizjologii. Łączy się z białkiem, aby wytworzyć hemoglobinę w krwinkach czerwonych i ma zasadnicze znaczenie w produkcji czerwonych krwinek (erytropoeza). Ciało przechowuje żelazo w wątrobie, śledzionie i szpiku kostnym. Większość żelaza potrzebnego każdego dnia do produkcji hemoglobiny pochodzi z recyklingu starych czerwonych krwinek.
Czerwone krwinki
Wytwarzanie czerwonych krwinek nazywa się erytropoezą. Przekształcenie dojrzałej komórki macierzystej w pełni funkcjonalną krwinkę czerwoną zajmuje około 7 dni. W miarę starzenia się czerwonych krwinek stają się one mniej aktywne i bardziej kruche.
Starzejące się krwinki czerwone są usuwane lub konsumowane przez rodzaj białych krwinek zwanych makrofagami w procesie znanym jako fagocytoza. Zawartość tych komórek jest uwalniana do krwi. Żelazo uwolnione w tym procesie przenosi się do szpiku kostnego w celu wytworzenia nowych krwinek czerwonych lub do wątroby lub innych tkanek do przechowywania.
Normalnie około 1 procent czerwonych krwinek w organizmie jest wymienianych każdego dnia. U zdrowej osoby każdego dnia wytwarza się około 200 miliardów czerwonych krwinek.
Białe krwinki
Szpik kostny wytwarza wiele rodzajów białych krwinek. Są one niezbędne dla zdrowego układu odpornościowego, zapobiegają i zwalczają infekcje.
Główne rodzaje białych krwinek lub leukocytów to:
- Limfocyty: Limfocyty są produkowane w szpiku kostnym. Wytwarzają naturalne przeciwciała przeciwdziałające infekcjom wywoływanym przez wirusy, które dostają się do organizmu przez nos, usta lub inną błonę śluzową lub poprzez nacięcia i otarcia. Specyficzne komórki rozpoznają obecność obcych najeźdźców (antygenów), które dostają się do organizmu i wysyłają sygnał do innych komórek w celu zaatakowania antygenów.
- Monocyty: Monocyty są produkowane w szpiku kostnym. Dojrzałe monocyty mają oczekiwaną długość życia we krwi zaledwie od 3 do 8 godzin, ale kiedy przenoszą się do tkanek, dojrzewają do większych komórek zwanych makrofagami. Makrofagi mogą przetrwać w tkankach przez długi czas, pochłaniając i niszcząc bakterie, niektóre grzyby, martwe komórki i inny materiał obcy dla organizmu.
- Granulocyty: Granulocyt to zbiorcza nazwa nadana trzem rodzajom białych krwinek: neutrofilom, eozynofilom i bazofilom. Rozwój granulocytów może zająć dwa tygodnie, ale czas ten ulega skróceniu w przypadku zwiększonego zagrożenia, takiego jak zakażenie bakteryjne. Szpik kostny przechowuje dużą rezerwę dojrzałych granulocytów. Dla każdego granulocyta krążącego we krwi może być od 50 do 100 komórek oczekujących w szpiku do uwolnienia do krwioobiegu. W rezultacie połowa granulocytów w krwi może być dostępna do aktywnej walki z infekcją w organizmie w ciągu 7 godzin od wykrycia infekcji.
- Neutrofile: Neutrofile są najczęstszym rodzajem granulocytów. Mogą atakować i niszczyć bakterie oraz wirusy.
- Eozynofile: Eozynofile biorą udział w walce z wieloma rodzajami pasożytniczych infekcji oraz przeciwko larwom pasożytniczych robaków i innych organizmów. Są zaangażowane także w niektóre reakcje alergiczne.
- Bazofile: Bazofile są najmniej powszechne z białych krwinek i reagują na różne alergeny, co powoduje uwalnianie histaminy, heparyny i innych substancji. Histamina jest środkiem rozszerzającym naczynia krwionośne, który powoduje podrażnienie i stan zapalny. Uwalnianie tych substancji sprawia, że patogen staje się bardziej przepuszczalny, co umożliwia wnikanie do tkanek białych krwinek i białek w celu zajęcia się patogenem.
Podrażnienie i stan zapalny w tkankach dotkniętych alergenem są częścią reakcji obserwowanej w katarze siennym, niektórych postaciach astmy, pokrzywkach, a w jej najpoważniejszej formie wstrząsie anafilaktycznym.
Płytki krwi
Szpik kostny produkuje płytki krwi w procesie znanym jako trombopoeza. Płytki krwi są niezbędne do krzepnięcia i tworzenia skrzepów, aby zatrzymać krwawienie.
Nagła utrata krwi wyzwala aktywność płytek krwi w miejscu urazu lub rany. Tutaj płytki gromadzą się razem i łączą z innymi substancjami, tworząc fibrynę. Fibryna ma strukturę przypominającą nitkę i tworzy zewnętrzny parch lub skrzep.
Niedobór płytek krwi powoduje łatwiejsze powstawanie siniaków i krwawienia. Krew może nie krzepnąć prawidłowo przy otwartej ranie, a ryzyko krwawienia wewnętrznego może być większe, jeśli liczba płytek krwi jest bardzo niska.
System limfatyczny
Układ limfatyczny składa się z narządów limfatycznych, takich jak szpik kostny, migdałki, grasica, śledziony oraz węzły chłonne.
Wszystkie limfocyty rozwijają się w szpiku kostnym z niedojrzałych komórek zwanych komórkami macierzystymi. Limfocyty dojrzewające w grasicy (za mostkiem) nazywane są limfocytami T, a te, które dojrzewają w szpiku kostnym lub narządach limfatycznych, nazywane są komórkami B.
System odpornościowy
Układ odpornościowy chroni organizm przed chorobą. Zabija niechciane mikroorganizmy, takie jak bakterie i wirusy, które mogą zaatakować organizm.
Jak układ odpornościowy zwalcza infekcję?
Małe gruczoły zwane węzłami chłonnymi są rozproszone po całym ciele. Po wytworzeniu limfocytów w szpiku, przemieszczają się one do węzłów chłonnych. Limfocyty mogą następnie przemieszczać się między każdym węzłem za pośrednictwem kanałów limfatycznych, które spotykają się w dużych kanałach odpływowych, opróżniających się do naczynia krwionośnego. Limfocyty dostają się do krwi przez te kanały.
Trzy główne typy limfocytów odgrywają ważną rolę w układzie odpornościowym:
Limfocyty B (komórki B)
Komórki te pochodzą z hematopoetycznych komórek macierzystych w szpiku kostnym u ssaków.
Komórki B wyrażają receptory komórek B (BCR) na powierzchni komórek. Umożliwiają one komórce przyłączenie się do antygenu na powierzchni atakującego drobnoustroju lub innego środka antygenowego.
Z tego powodu komórki B są znane jako komórki prezentujące antygen, ponieważ ostrzegają inne komórki układu odpornościowego przed inwazyjnym drobnoustrojem.
Komórki B wydzielają również przeciwciała, które przyczepiają się do powierzchni drobnoustrojów wywołujących infekcję. Przeciwciała te mają kształt litery Y, a każdy z nich jest zbliżony do wyspecjalizowanego «zamka», do którego pasuje pasujący antygen «klucz». Jako takie, każde przeciwciało w kształcie litery Y reaguje na inny drobnoustrój, wywołując większą odpowiedź układu odpornościowego w celu zwalczania infekcji.
W niektórych okolicznościach komórki B błędnie identyfikują normalne komórki ludzkiego ciała jako antygeny wymagające reakcji układu odpornościowego. Jest to mechanizm odpowiedzialny za rozwój chorób autoimmunologicznych, takich jak stwardnienie rozsiane, twardzina i cukrzyca typu 1.
Limfocyty T (komórki T)
Komórki te są tak nazwane, ponieważ dojrzewają w grasicy, małym narządzie w górnej klatce piersiowej, tuż za mostkiem (niektóre komórki T dojrzewają w migdałkach). Istnieje wiele różnych typów komórek T, które pełnią szereg funkcji w ramach adaptacyjnej odporności komórkowej. Komórki T pomagają komórkom B wytwarzać przeciwciała przeciwko atakującym bakteriom, wirusom lub innym drobnoustrojom.
W przeciwieństwie do komórek B, niektóre komórki T pochłaniają i niszczą patogeny bezpośrednio, po związaniu się z antygenem na powierzchni drobnoustroju.
Naturalne zabójcze komórki T, których nie należy mylić z naturalnymi komórkami zabójcy wrodzonego układu odpornościowego, łączą adaptacyjne i wrodzone układy odpornościowe. Komórki NKT rozpoznają antygeny przedstawione w inny sposób niż wiele innych antygenów i mogą pełnić funkcje komórek pomocniczych T oraz komórek T cytotoksycznych. Mogą także rozpoznawać i eliminować niektóre komórki nowotworowe.
Naturalne komórki zabójcy (NK)
Jest to rodzaj limfocytu, który atakuje bezpośrednio komórki zainfekowane wirusem.
Przeszczepy
Przeszczep szpiku kostnego może być stosowany z różnych powodów.
- Może zastąpić chory, niefunkcjonujący szpik kostny zdrowym, funkcjonującym szpikiem kostnym. Jest to stosowane w przypadku takich chorób jak białaczka, niedokrwistość aplastyczna i anemia sierpowata.
- Może regenerować nowy układ odpornościowy, który zwalcza istniejącą lub szczątkową białaczkę lub inne nowotwory, które nie zostały zniszczone chemioterapią lub radioterapią.
- Może zastąpić szpik kostny i przywrócić jego prawidłową funkcję po podaniu dużych dawek chemioterapii lub radioterapii w celu leczenia nowotworu złośliwego.
- Może zastąpić szpik kostny genetycznie zdrowym, funkcjonującym szpikiem kostnym, aby zapobiec dalszym uszkodzeniom spowodowanym genetycznym procesem chorobowym, takim jak zespół Hurlera czy adrenoleukodystrofia.
Komórki macierzyste znajdują się głównie w czterech miejscach:
- zarodek
- szpik kostny
- krew obwodowa, znaleziona w naczyniach krwionośnych w całym ciele
- krew pępowinowa, znaleziona w pępowinie i zebrana po urodzeniu.
Komórki macierzyste do transplantacji uzyskuje się z dowolnego z tych miejsc, z wyjątkiem płodu.
Hematopoetyczny przeszczep komórek macierzystych obejmuje dożylny wlew komórek macierzystych pobranych ze szpiku kostnego, krwi obwodowej lub krwi pępowinowej.
Jest on stosowany w celu przywrócenia funkcji krwiotwórczej u pacjentów, u których szpik kostny lub układ immunologiczny są uszkodzone lub zniszczone.
Ponad 50 000 pierwszych procedur transplantacji krwiotwórczych komórek macierzystych, 28 000 autologicznych procedur transplantacyjnych i 21 000 allogenicznych procedur przeszczepów wykonuje się co roku na całym świecie, zgodnie z pierwszym raportem z Ogólnoświatowej Sieci Przeszczepu Krwi i Szpiku.
Liczba ta stale rośnie o 10 do 20 procent rocznie. Zmniejszenie uszkodzeń narządów, infekcji i ciężkiej, ostrej choroby przeszczep przeciwko gospodarzowi (GVHD) wydaje się przyczyniać do poprawy wyników.
W badaniu 854 pacjentów, którzy przeżyli co najmniej 2 lata po autologicznym przeszczepieniu komórek krwiotwórczych (HSCT) w kierunku złośliwości hematologicznej, 68,8 procent było wciąż żyjących 10 lat po transplantacji.
Przeszczep szpiku kostnego jest wiodącym sposobem leczenia schorzeń zagrażających zdolności szpiku kostnego do funkcjonowania, takich jak białaczka.
Przeszczep może pomóc odbudować zdolność organizmu do produkcji komórek krwi i doprowadzić ich liczbę do normalnego poziomu. Choroby, które można leczyć za pomocą przeszczepu szpiku kostnego, obejmują choroby nowotworowe i nierakowe.
Choroby nowotworowe mogą, lecz nie muszą, obejmować krwinki, ale leczenie raka może zniszczyć zdolność organizmu do wytwarzania nowych komórek krwi.
Osoba z rakiem zwykle przechodzi chemioterapię przed przeszczepem. To wyeliminuje uszkodzony szpik.
Pasujący dawcy, w większości przypadków bliski członek rodziny, następnie pobiera szpik kostny i przygotowuje do przeszczepu.
Rodzaje przeszczepu szpiku kostnego
Rodzaje przeszczepu szpiku kostnego obejmują:
- Przeszczep autologiczny: pacjenci otrzymują własne komórki macierzyste pobrane z krwi obwodowej lub pępowinowej w celu uzupełnienia szpiku kostnego.
- Przeszczepienie syngeniczne: pacjenci otrzymują komórki macierzyste od identycznego bliźniaka.
- Allogeniczny przeszczep: pacjenci otrzymują pasujące komórki macierzyste od rodzeństwa, rodzica lub niepowiązanego dawcy.
- Haploidentyczne przeszczepy: opcja leczenia dla około 70% pacjentów, którzy nie mają identycznego pasującego dawcy HLA.
- Krew pępowinowa: rodzaj allogenicznego przeszczepu. Komórki macierzyste są usuwane z pępowiny noworodków tuż po urodzeniu. Komórki macierzyste są zamrażane i przechowywane do czasu, aż będą potrzebne do przeszczepu. Komórki krwi pępowinowej są bardzo niedojrzałe, więc nie ma potrzeby dopasowywania, ale odliczanie krwi trwa dłużej.
Rodzaj tkanki
Typ tkanki danej osoby definiuje się jako rodzaj ludzkiego antygenu leukocytowego (HLA) na powierzchni większości komórek ciała. HLA to białko lub marker, którego używa organizm, aby pomóc określić, czy komórka należy do organizmu, czy nie.
Aby sprawdzić, czy rodzaj tkanki jest zgodny, lekarze oceniają, ile białek pasuje do powierzchni komórek dawcy i biorcy. Istnieją miliony różnych typów tkanek, ale niektóre są bardziej powszechne niż inne.
Rodzaj tkanki jest dziedziczony, a typy są przekazywane z każdego z rodziców, co oznacza, że krewny będzie miał większe prawdopodobieństwo posiadania odpowiedniego typu tkanki.
Jednakże, jeśli odpowiedniego dawcy szpiku kostnego nie można znaleźć od członków rodziny, lekarze będą próbowali znaleźć kogoś z kompatybilnym typem tkanki w rejestrze dawcy szpiku kostnego.
Testy przed przeszczepieniem
Przeprowadzono kilka testów przed przeszczepem szpiku kostnego, aby zidentyfikować potencjalne problemy.
Testy obejmują:
- Typowanie tkanek i różne testy krwi.
- Rentgen klatki piersiowej.
- Testy czynności płuc.
- Skanowanie CT lub CAT.
- Testy czynności serca, obejmujące elektrokardiogram i echokardiogram (EKG).
- Biopsja szpiku kostnego.
- Badanie szkieletowe.
Ponadto przed przeszczepem szpiku kostnego niezbędny jest kompletny egzamin stomatologiczny, aby zmniejszyć ryzyko infekcji. Przed przeszczepieniem zostaną również podjęte inne środki ostrożności w celu zmniejszenia ryzyka zakażenia pacjenta.
Zbiór szpiku kostnego
Szpik kostny można uzyskać do badania za pomocą biopsji szpiku kostnego i aspiracji szpiku kostnego.
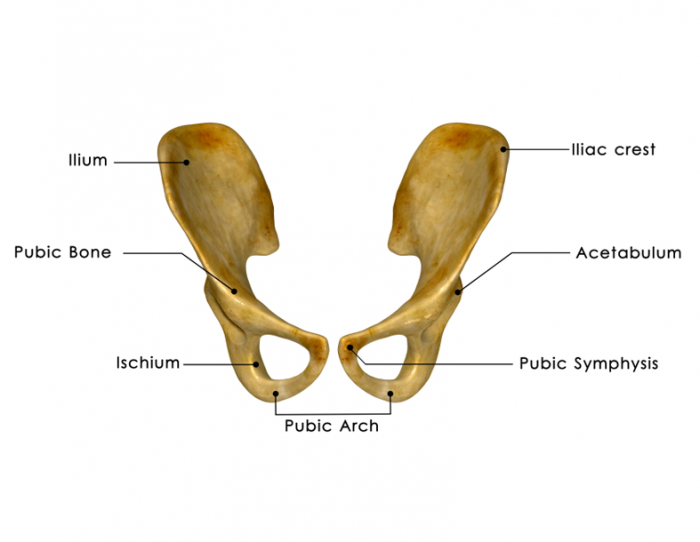
Pobieranie szpiku kostnego stało się stosunkowo rutynową procedurą. Zasadniczo jest pobierany z tylnego grzebienia biodrowego, podczas gdy dawca jest znieczulany na poziomie regionalnym lub ogólnym.
Można go również pobrać z mostka i od górnej kości piszczelowej u dzieci, ponieważ nadal zawiera znaczną ilość czerwonego szpiku kostnego.
Lekarz włoży igłę do kości, zwykle w biodro, i wycofa część szpiku kostnego. Następnie jest przechowywany i zamrażany.
Wytyczne ustalone przez program dawcy szpiku (NMDP) ograniczają objętość szpiku kostnego usuniętą do 15 ml / kg wagi dawcy. Dawka 1 X 103 i 2 X 108 komórek jednojądrzastych szpiku na kilogram jest wymagana do ustalenia przeszczepu w autologicznych i allogenicznych przeszczepach szpiku.
Powikłania związane ze zbieraniem szpiku kostnego są rzadkie. Obejmują problemy związane ze znieczuleniem, infekcją i krwawieniem.
Innym sposobem oceny czynności szpiku kostnego jest podanie pewnych leków, które stymulują uwalnianie komórek macierzystych ze szpiku kostnego do krwi krążącej. Następnie pobiera się próbkę krwi, a komórki macierzyste izoluje się do badania mikroskopowego. U noworodków komórki macierzyste można pobrać z pępowiny.
Jak przeszczepiony jest szpik kostny?
Przed przeszczepem można podać chemioterapię, promieniowanie lub oba. Można to zrobić na dwa sposoby:
- Leczenie ablacyjne (mieloablacyjne): Chemioterapia wysokimi dawkami, napromienianie lub oba są podawane w celu zabicia komórek rakowych. To również zabija cały zdrowy szpik kostny, który pozostaje, i pozwala nowym komórkom macierzystym rosnąć w szpiku kostnym.
- Leczenie o zmniejszonej intensywności lub mini przeszczep: Pacjenci otrzymują niższe dawki chemioterapii i radioterapii przed przeszczepem. Umożliwia to przeszczepienie starszym pacjentom i osobom z innymi problemami zdrowotnymi.
Przeszczep komórek macierzystych zwykle przeprowadza się po zakończeniu chemioterapii i radioterapii.
Infuzja szpiku kostnego lub krwi obwodowej jest stosunkowo prostym procesem wykonywanym przy łóżku chorego. Produkt szpiku kostnego podaje się przez żyłę centralną przez rurkę dożylną w ciągu kilku godzin. Produkty autologiczne są prawie zawsze zamrożone; są rozmrażane przy łóżku i szybko podawane w ciągu kilku minut.
Po wejściu do krwiobiegu hematopoetyczne komórki macierzyste przemieszczają się do szpiku kostnego. Tam zaczynają wytwarzać nowe białe krwinki, czerwone krwinki i płytki krwi w procesie znanym jako wszczepienie. Zazwyczaj wszczepienie następuje po 2 do 4 tygodniach od transplantacji.
W większości przypadków zaobserwowano minimalną toksyczność. Niedopasowane ABO infuzje szpiku kostnego mogą czasami prowadzić do reakcji hemolitycznych. Dimetylosulfotlenek (DMSO), który jest stosowany do kriokonserwacji komórek macierzystych, może powodować zaczerwienienie twarzy, uczucie łaskotania w gardle i silny smak w ustach (smak czosnku). Rzadko DMSO może powodować bradykardię, bóle brzucha, encefalopatię lub drgawki oraz niewydolność nerek.
Aby uniknąć ryzyka encefalopatii, która występuje przy dawkach powyżej 2 g / kg / dzień DMSO, infuzje komórek macierzystych przekraczające 500 ml są podawane w infuzji przez 2 dni, a szybkość infuzji jest ograniczona do 20 ml / min.
Lekarze regularnie sprawdzają liczbę krwinek. Całkowite odzyskanie funkcji immunologicznej może potrwać kilka miesięcy u autologicznych biorców przeszczepów oraz od 1 do 2 lat u pacjentów otrzymujących allogeniczne lub syngeniczne przeszczepy.
Badania krwi potwierdzą, że produkowane są nowe komórki krwi i że rak nie powrócił. Aspiracja szpiku kostnego może również pomóc lekarzom określić, jak dobrze działa nowy szpik.
Ryzyka
Powikłania związane z HSCT obejmują zarówno wczesne, jak i późne efekty.
Problemy z wczesnym początkiem obejmują:
- zapalenie śluzówki;
- krwotoczne zapalenie pęcherza moczowego;
- długotrwała, ciężka pancytopenia;
- infekcja;
- GVHD (choroba przeszczep przeciwko gospodarzowi);
- niepowodzenie przeszczepu;
- powikłania płucne;
- wątrobowa choroba zakrzepowo-żylna;
- mikroangiopatia zakrzepowa.
Problemy z późnym wystąpieniem obejmują:
- przewlekła GVHD;
- efekty oczne;
- efekty endokrynologiczne;
- efekty płucne;
- działanie na mięśnie szkieletowe;
- efekty neurologiczne;
- efekty immunologiczne;
- infekcja;
- zastoinowa niewydolność serca;
- późniejsza złośliwość.
Główne zagrożenia obejmują zwiększoną podatność na infekcje, anemię, niewydolność przeszczepu, niewydolność oddechową i nadmiar płynu, który może prowadzić do zapalenia płuc i zaburzeń czynności wątroby.
Niedopasowanie między tkankami dawcy i biorcy może prowadzić do reakcji odpornościowej pomiędzy komórkami gospodarza i komórkami przeszczepu.
Gdy przeszczepione komórki atakują komórki gospodarza, wynikiem jest niebezpieczny stan zwany chorobą przeszczepu przeciwko gospodarzowi (GVHD), który może być ostry lub przewlekły i może objawiać się wysypką skórną, chorobą żołądkowo-jelitową lub chorobą wątroby. Ryzyko związane z GVHD można zminimalizować poprzez staranne dopasowanie tkanki.
Nawet gdy antygen dawcy jest identyczny, około 40% biorców nadal rozwija GVHD, wzrastając do 60-80 procent, gdy tylko pojedynczy antygen jest niedopasowany. Z powodu niebezpieczeństwa tego powikłania autologiczne przeszczepy są częściej wykonywane.
Przeszczep szpiku kostnego nie był wcześniej zalecany pacjentom w wieku powyżej 50 lat, ze względu na wyższą śmiertelność i częstość zachorowań oraz zwiększoną częstość występowania GVHD u osób w wieku powyżej 30 lat. Jednak wiele ośrodków transplantologicznych przeprowadziło udane transplantacje szpiku u pacjentów w wieku powyżej 50 lat.
Istnieje niewielkie ryzyko dla ofiarodawców, ponieważ generują nowy szpik dla zastąpienia tego, który został usunięty. Istnieje jednak niewielkie ryzyko infekcji, a reakcja na znieczulenie może wystąpić przy każdej operacji chirurgicznej.
Choroby
Ponieważ szpik kostny wpływa na wiele układów organizmu, problemy mogą prowadzić do wielu chorób, w tym nowotworów, które wpływają na krew.
Szereg chorób stwarza zagrożenie dla szpiku kostnego, ponieważ zapobiega przekształcaniu szpiku kostnego w komórki podstawowe.
Białaczka, choroba Hodgkina i inne nowotwory chłoniaka mogą uszkadzać zdolność produkcyjną szpiku i niszczyć komórki macierzyste.
Badanie szpiku kostnego może pomóc zdiagnozować:
- białaczkę;
- szpiczak mnogi;
- chorobę Gauchera;
- nietypowe przypadki niedokrwistości;
- inne choroby hematologiczne.
Rosnąca liczba chorób może być leczona za pomocą hematopoetycznego transferu komórek macierzystych (HSCT).
Ponad połowa autologicznych przeszczepów jest wykonywana w celu leczenia szpiczaka mnogiego i chłoniaka nieziarniczego. Większość allogenicznych przeszczepów wykonuje się w przypadku nowotworów hematologicznych i limfoidalnych.
Co 4 minuty w Stanach Zjednoczonych ktoś otrzymuje diagnozę raka krwi. Przeszczep szpiku kostnego jest często najlepszą szansą na przeżycie.
Około 30 procent pacjentów może znaleźć pasującego dawcę w swoich rodzinach, ale 70 procent, lub około 14 000 każdego roku, polega na szpiku oddawanym przez kogoś niezwiązanego.
Autologiczny HSCT jest obecnie stosowany w leczeniu:
- szpiczaka mnogiego;
- chłoniaka nieziarniczego;
- chłoniaka Hodgkina;
- ostrej białaczki szpikowej;
- nerwiaka niedojrzałego;
- guzy zarodkowe;
- zaburzenia autoimmunologiczne, takie jak układowy toczeń rumieniowaty i twardzina układowa;
- amyloidoza.
Allogeniczny HSCT stosuje się w leczeniu:
- ostrej białaczki szpikowej;
- ostrej białaczki limfoblastycznej;
- przewlekłej białaczki szpikowej;
- przewlekłej białaczki limfatycznej;
- zaburzeń mieloproliferacyjnych;
- zespołów mielodysplastycznych;
- szpiczaka mnogiego;
- chłoniaka nieziarniczego;
- chłoniaka Hodgkina;
- niedokrwistości aplastycznej;
- czystej aplazji krwinek czerwonych;
- napadowej nocnej hemoglobinurii;
- anemii Fanconiego;
- talasemii major;
- anemii sierpowatej;
- ciężkiego złożonego niedoboru odporności (SCID);
- zespołu Wiskotta-Aldricha;
- limfohistiocytozy hemofagocytarnej;
- zaburzeń genetycznych związanych z metabolizmem, takich jak mukopolisacharydoza;
- choroby Gauchera, leukodystrofie metachromatyczne i adrenoleukodystrofie;
- epidermolizę bulla;
- ciężką wrodzoną neutropenię;
- zespół Shwachman-Diamond;
- niedokrwistość Diamond-Blackfan;
- niedobór adhezji leukocytów.
HSCT może również pomóc w leczeniu:
- raka piersi, chociaż nie jest to potwierdzone;
- raka jądra, u niektórych pacjentów we wczesnym stadium;
- niektóre genetyczne zaburzenia immunologiczne lub hematopoetyczne.
Przeszczepy szpiku kostnego są czasem potrzebne po pewnych terapiach, takich jak chemioterapia wysokimi dawkami i radioterapia, stosowane w leczeniu raka. Te zabiegi mają tendencję do uszkadzania zdrowych komórek macierzystych, jak również niszczenia komórek nowotworowych.
Testy szpiku kostnego
Testy szpiku kostnego mogą pomóc w diagnozowaniu niektórych chorób, szczególnie tych związanych z krwią i narządami krwiotwórczymi. Testowanie dostarcza informacji na temat zapasów żelaza i produkcji krwi.
Aspiracja szpiku kostnego wykorzystuje wydrążoną igłę do usunięcia małej próbki (około 1 ml) szpiku kostnego do badania pod mikroskopem.
Igła jest zwykle umieszczana w biodrze lub mostku u dorosłych i w górnej części kości piszczelowej (większa kość dolnej części nogi) u dzieci, a ssanie jest używane do ekstrakcji próbki.
Aspiracja szpiku kostnego jest zwykle wykonywana, gdy jest wskazana przez wcześniejsze badania krwi i jest szczególnie użyteczna w dostarczaniu informacji na różnych etapach niedojrzałych komórek krwi.
Darowizna
Istnieją dwa główne rodzaje dawstwa szpiku kostnego.
Pierwszy polega na usunięciu szpiku kostnego z tylnej części kości miednicy.
Druga, bardziej powszechna metoda, nazywana jest darowizną komórek macierzystych krwi obwodowej (PBSC). Obejmuje to filtrowanie komórek macierzystych bezpośrednio z krwi. To właśnie komórki macierzyste krwi, a nie sam szpik kostny, są niezbędne do leczenia nowotworów krwi i innych chorób.
Kiedy dana osoba dołącza do rejestru dawstwa szpiku, zgadza się na oddanie krwi za pomocą dowolnej metody, którą lekarz uzna za stosowną.
Jeśli chodzi o koszty, koszt przekazania darowizny jest zwykle pokryty przez NMDP lub ubezpieczenie medyczne pacjenta. Darczyńcy nigdy nie płacą za darowizny i nigdy nie otrzymują zapłaty za darowiznę.
Ryzyko dla dawcy jest minimalne. Ponad 99 procent dawców robi pełne wyleczenie po zabiegu. W przypadku oddawania szpiku głównym ryzykiem jest znieczulenie podczas samej procedury.
Z darowizną PBSC sama procedura, która polega na filtrowaniu krwi przez maszynę, nie jest uważana za niebezpieczną.
Szansa znalezienia odpowiedniego dawcy szpiku wynosi od 66 do 93 procent, w zależności od przynależności etnicznej.
Kto może ofiarować szpik kostny
Poniżej przedstawiono kilka ogólnych wskazówek dotyczących dawstwa szpiku kostnego, zgodnie z zaleceniami Narodowego Programu Dawcy Szpiku (NMDP).
Wytyczne mają na celu ochronę zdrowia i bezpieczeństwa dawcy i biorcy. Zachęca się darczyńców do skontaktowania się z lokalnym ośrodkiem NMDP w celu uzyskania szczegółowych informacji i omówienia darowizn z zespołem opieki zdrowotnej.
- Aby znaleźć się w rejestrze, potencjalni darczyńcy muszą być zdrowi i mieć od 18 do 60 lat.
- W przypadku dopasowania do osoby wymagającej przeszczepu, każdy dawca musi zdać badanie lekarskie i być wolny od infekcji przed przekazaniem darowizny.
- Osoby, które stosowały leki, zwykle mogą przekazywać szpik kostny, o ile są zdrowe, a wszelkie medyczne warunki, które mają, są pod kontrolą w momencie dawstwa.
Dopuszczalne leki obejmują pigułki antykoncepcyjne, leki na tarczycę, leki przeciwhistaminowe, antybiotyki, krople do oczu na receptę i leki miejscowe, takie jak kremy do skóry. Leki przeciwdepresyjne są dozwolone, o ile stan jest pod kontrolą.
Darowizna nie jest możliwa:
- podczas ciąży;
- przez nikogo zażywającego leki dożylne, które nie są przepisywane przez lekarza;
- jeśli osoba miała pozytywny wynik badania krwi na zapalenie wątroby typu B lub C;
- przez osoby z określonymi schorzeniami, takimi jak większość rodzajów raka lub niektóre choroby serca.
Osoby cierpiące na boreliozę, malarię lub niedawne tatuaże lub kolczyki powinny odczekać co najmniej rok przed oddaniem szpiku.
W jaki sposób określa się dopasowanie szpiku kostnego?
Po rejestracji na darowiznę osoba podejmie test typowania HLA, który jest wykorzystywany do łączenia pacjentów z potencjalnymi dawcami.
Ich typ HLA zostanie następnie dodany do bazy danych potencjalnych dawców, a lekarz przeszuka rejestr w celu znalezienia dopasowania dla ich pacjenta.
Białka w komórkach krwi zostaną porównane, aby zobaczyć, czy są one podobne do tych u biorcy. Potencjalny dawca skontaktuje się z Tobą, jeśli będzie mecz.
Im bardziej podobny jest typ tkanki dawcy do pacjenta, tym większa szansa, że ciało pacjenta zaakceptuje przeszczep.
Dawcy szpiku kostnego na całym świecie (BMDW) to zbiorowa baza danych 59 rejestrów w 43 krajach i 37 rejestrów krwi pępowinowej z 21 krajów; 26,35 miliona potencjalnych dawców komórek macierzystych i 687 tysięcy komórek krwi pępowinowej było dostępnych we wrześniu 2015 roku. Wstępne poszukiwania przez NMDP rutynowo badają także BMDW.
Co dzieje się przy przekazywaniu szpiku kostnego?
Następujące badania są rutynowo wykonywane na hematopoetycznych dawcach komórek macierzystych:

- historia i badanie fizykalne;
- badanie stężenia kreatyniny w surowicy, elektrolitów i czynności wątroby;
- badania serologiczne nad cytomegalowirusem (CMV), wirusami opryszczki, HIV RNA, przeciwciałami przeciw HIV, wirusami zapalenia wątroby typu B i C, ludzkim limfotropowym wirusem limfocytów T-1/2 (HTLV-I / II) i kiłą (VDRL); w darach autologicznych badania CMV i VDRL nie są wymagane;
- ABO pisania krwi;
- pisanie HLA;
- radiografia klatki piersiowej;
- elektrokardiografia (EKG).
Przekazywanie komórek macierzystych krwi obwodowej (PBSC)
Zanim osoba może przekazać PBSC, będzie musiała poddać się codziennym zastrzykom z lekiem zwanym filgrastym w ciągu pięciu dni poprzedzających zabieg. Ten lek pobiera komórki macierzyste ze szpiku kostnego, więc dawcy będą mieli więcej krążących we krwi.
Darowizna PBSC obejmuje procedurę znaną jako afereza. To wtedy pobiera się krew z ciała za pomocą cewnika umieszczonego w jednym ramieniu i przepuszcza przez maszynę, odfiltrowując komórki macierzyste oraz płytki krwi i krwinki białe. Pozostała krew (składająca się głównie z osocza i czerwonych krwinek) następnie wraca do ciała przez żyłę w drugim ramieniu.
Zabieg jest całkowicie bezbolesny i przypomina dawkowanie osocza. Darowizna PBSC zwykle wymaga od dwóch do czterech sesji, każda trwająca od 2 do 6 godzin.
Darowizna PBSC nie wymaga znieczulenia. Lek podawany w celu pobudzenia mobilizacji (uwalniania) komórek macierzystych ze szpiku do krwioobiegu może powodować bóle kości i mięśni, bóle głowy, zmęczenie, nudności, wymioty lub trudności w zasypianiu. Te działania niepożądane zazwyczaj ustępują w ciągu 2 do 3 dni od ostatniej dawki leku.
Darowizna szpiku kostnego
Jeśli osoba przekazuje rzeczywisty szpik kostny zamiast PBSC, nie ma potrzeby stosowania zastrzyków filgrastymu. Dawstwo szpiku kostnego to zabieg chirurgiczny przeprowadzany w sali operacyjnej, który wymaga znieczulenia i dlatego jest całkowicie bezbolesny. Cała procedura trwa od 1 do 2 godzin.
W 96 procentach przypadków stosuje się znieczulenie ogólne, co oznacza, że dawcy będą nieprzytomni podczas całej procedury. W niewielkiej liczbie przypadków stosuje się znieczulenie miejscowe, które po prostu zniekształca obszar, z którego pobierany jest szpik kostny. W tej sytuacji osoba będzie się budzić podczas całej procedury.
Osoba leży na brzuchu. Lekarze wykonają nacięcie o długości około ćwierć cala po obu stronach kości miednicy. Następnie wkładają do kości specjalne, puste w środku igły, przez które ciągną ciekły szpik. Nacięcia zwykle nie wymagają szwów.
Po zabiegu dawcy pozostaną w sali pooperacyjnej, dopóki nie odzyskają przytomności. Gdy będą mogli jeść, pić i chodzić, będą mogli odejść.
Poprawa
Po donacji całkowite wyleczenie może potrwać kilka dni, szczególnie jeśli chodzi o zabieg chirurgiczny.
Osoby, które przekazują szpik kostny, często doświadczają bólów głowy, zmęczenia, bólu mięśni, pleców lub bioder, siniaków wokół miejsca nacięcia oraz trudności w chodzeniu. Może to trwać do 2 dni lub nawet przez kilka tygodni.
Osoba, która ofiaruje PBSC, prawdopodobnie nie odczuje żadnych skutków ubocznych po dawstwie, poza siniakami w miejscu nakłucia. Czas odzyskiwania jest prawie natychmiastowy.
Po donacji szpik kostny zastępuje się w ciągu 4 do 6 tygodni.
Wynik
Wynik przeszczepu szpiku kostnego zależy od:
- Rodzaju przeszczepu;
- jak blisko pasują komórki;
- jakiego rodzaju stan ma pacjent;
- wiek pacjenta i ogólny stan zdrowia;
- rodzaj i dawkowanie chemioterapii lub radioterapii stosowanej przed przeszczepem;
- jakiekolwiek komplikacje.
Pacjent, którego stan jest stabilny lub w stanie remisji, ma większą szansę na dobry wynik w porównaniu z osobą, która ma przeszczep w późniejszym stadium lub z nawrotową chorobą. Młody wiek w momencie przeszczepu również zwiększa szanse.
Przeszczepy na choroby niezłośliwe zwykle mają bardziej korzystne wyniki, z współczynnikiem przeżycia wynoszącym 70 do 90 procent, jeśli dawcą jest dobrane rodzeństwo, i 36 do 65 procent, jeśli dawcy nie ma związku.
Przeszczepy ostrej białaczki w remisji w momencie przeszczepu mają wskaźnik przeżywalności od 55 do 68 procent, jeśli dawcy są spokrewnione, a 26 do 50 procent, jeśli dawcy nie ma związku.
Przeszczep szpiku kostnego może całkowicie lub częściowo wyleczyć chorobę. Jeśli przeszczep powiedzie się, jednostki mogą wrócić do większości normalnych czynności, gdy tylko poczują się wystarczająco dobrze. Pełne odzyskiwanie zazwyczaj trwa do roku.
Nowe badania i statystyki
W 2024 roku badania nad szpikiem kostnym koncentrują się na nowych metodach leczenia, takich jak terapia komórkowa oraz nanotechnologia w diagnostyce chorób hematologicznych. Zastosowanie sztucznej inteligencji w analizie danych pacjentów przynosi obiecujące wyniki w przewidywaniu skuteczności przeszczepów oraz w doborze dawców.
Ponadto, nowe badania wykazują, że implementacja programów edukacyjnych zwiększa liczbę rejestracji dawców szpiku kostnego, co jest kluczowe dla poprawy wyników leczenia. Z danych wynika, że w ostatnich latach nastąpił wzrost liczby przeszczepów o 15%, co daje nadzieję na lepszą dostępność terapii dla pacjentów.
Wzrost świadomości na temat znaczenia dawców szpiku kostnego wśród młodszych pokoleń przyczynia się do wzrostu liczby rejestracji i lepszej zgodności dawców. W 2023 roku zarejestrowano ponad 50 000 nowych dawców, co jest rekordową liczbą w historii.
Te innowacje i dane podkreślają, jak ważne jest dalsze wsparcie badań oraz edukacji w dziedzinie transplantacji szpiku kostnego, aby zapewnić lepsze wyniki zdrowotne dla pacjentów na całym świecie.