Tumefaktywne stwardnienie rozsiane to rzadko spotykana forma stwardnienia rozsianego, która charakteryzuje się obecnością masy w mózgu. Może być mylona z innymi schorzeniami, w tym nowotworami czy gruźliczakami.
Stwardnienie rozsiane (SM) to choroba, która oddziałuje na centralny układ nerwowy, uszkadzając ochronną osłonkę mielinową nerwów. Osłonka mielinowa jest kluczowa dla przewodzenia sygnałów elektrycznych w organizmie. U osób z SM następuje jej uszkodzenie, co prowadzi do powstawania blizn i obszarów demielinizacji, a w konsekwencji do uszkodzenia włókien nerwowych oraz utraty różnych funkcji.
Gdy osłona mielinowa jest uszkodzona, impulsy elektryczne przesyłane z mózgu do mięśni mogą nie działać prawidłowo, co powoduje szereg objawów neurologicznych.
Co to jest tumefactive MS?
Tumefaktywne stwardnienie rozsiane to rzadki typ SM, który często mylony jest z guzem mózgu, nowotworem lub infekcją.
Podczas diagnozy, tumefaktywne SM może przypominać guz mózgu, ropień, gruźlicę, pierwotny zespół Sjögrena, sarkoidozę czy inne stany zapalne.
Objawy
Osoby z tumefaktywnym SM mogą doświadczać objawów, które są mniej typowe dla ogólnego stwardnienia rozsianego.
Objawy, które mogą sugerować nowotworowe pochodzenie, obejmują:
- bóle głowy
- zamieszanie umysłowe
- zmiany w zdolności poznawczej
- trudności w mówieniu i rozumieniu mowy
- drgawki
- słabość mięśniową
- nudności i wymioty
Do bardziej ogólnych objawów SM należą:
- zmęczenie i osłabienie
- drętwienie i mrowienie
- trudności w chodzeniu
- sztywność oraz mimowolne skurcze mięśni
- niewyraźne widzenie, zmiany w percepcji kolorów oraz ból przy ruchu gałek ocznych
- zawroty głowy
- dysfunkcja pęcherza moczowego
- problemy seksualne
- zaparcia i nietrzymanie stolca
- ból
Osoby z SM mogą również doświadczać zmian w umiejętności rozwiązywania problemów, koncentracji oraz zdolności uczenia się i zapamiętywania nowych informacji.
Przyczyny i czynniki ryzyka

Chociaż dokładna przyczyna tumefaktywnego SM nie jest w pełni zrozumiana, uważa się, że genetyka oraz czynniki środowiskowe mogą odgrywać kluczową rolę w rozwoju tej choroby.
Dzieci osób chorych na SM mają większe ryzyko rozwoju tej choroby.
Inne czynniki ryzyka obejmują:
- wiek między 20 a 50 rokiem życia
- płeć żeńska, szczególnie w przypadku przodków z Europy Północnej
- zamieszkiwanie w rejonach oddalonych od równika
- posiadanie w rodzinie osoby z SM, w tym rodziców, rodzeństwa lub bliźniaków jednojajowych
Jedna z teorii sugeruje, że infekcje bakteryjne lub wirusowe mogą przyczyniać się do rozwoju SM, choć na ten temat brakuje jednoznacznych dowodów.
Diagnoza
Diagnostyka tumefaktywnego SM może być dla lekarzy wyzwaniem, ponieważ choroba ta często przypomina inne schorzenia, w tym nowotwory mózgu czy infekcje.
Z uwagi na podobieństwa do innych stanów, konieczne mogą być różnorodne badania w celu potwierdzenia rozpoznania oraz wykluczenia innych potencjalnie zagrażających życiu chorób.
Do testów diagnostycznych zalicza się:
- rezonans magnetyczny (MRI)
- biopsję mózgu
- nakłucie lędźwiowe
- testy funkcji nerwów
- badania krwi
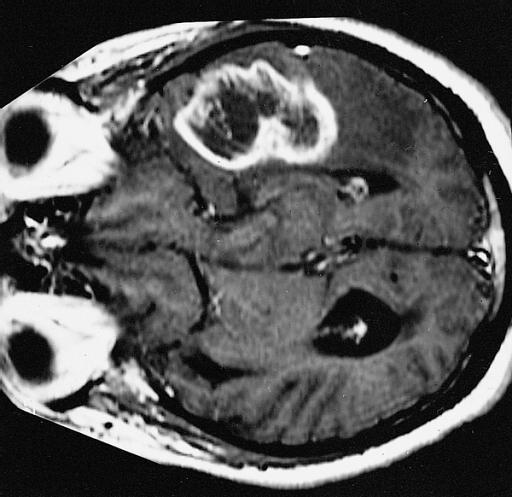
W przypadku pacjentów z tumefaktywnym SM często występuje co najmniej jedno uszkodzenie mózgu większe niż 2 centymetry, towarzyszące obrzękowi mózgu.
Może także wystąpić efekt masowy, który polega na uszkodzeniu otaczających tkanek mózgowych. Efekt masowy może powodować nudności, senność, bóle głowy, zaburzenia widzenia oraz zmiany w zachowaniu.
Leczenie

Obecnie nie ma lekarstwa na tumefaktywne SM. Wiele osób z tą formą SM przechodzi w bardziej powszechną postać, znaną jako nawracająco-remisyjne stwardnienie rozsiane (RRMS).
Osoby z RRMS doświadczają okresów nawrotów oraz remisji. To oznacza, że mogą mieć chwile, gdy objawy ustępują, ale również okresy, kiedy symptomy powracają lub pojawiają się nowe.
Choć nie zawsze można wskazać jednoznaczną przyczynę nawrotu, istnieją czynniki, które mogą go wywoływać, takie jak:
- stres
- ciąża
- szczepienia
- infekcje
Niektórzy pacjenci wracają do zdrowia po nawrocie, podczas gdy inni zmagają się z przewlekłymi objawami.
Dostępne są leki zmniejszające częstotliwość nawrotów w przypadku RRMS.
Leki do wstrzykiwania obejmują:
- Avonex (interferon beta-1a)
- Betaseron (interferon beta-1b)
- Copaxone (octan glatirameru)
- Extavia (interferon beta-1b)
- Plegridy (peginterferon beta-1a)
- Rebif (interferon beta-1a)
- Zinbryta (daclizumab)
Dostępne są także leki doustne takie jak:
- Aubagio (teriflunomid)
- Gilenya (fingolimod)
- Tecfidera (fumaran dimetylu)
Leki dożylne obejmują:
- Lemtrada (alemtuzumab)
- Novantrone (mitoksantron)
- Ocrevus (ocrelizumab)
- Tysabri (natalizumab)
Inne leki mogą być zalecane w zależności od objawów oraz historii medycznej pacjenta.
Ciężkie nawroty mogą być leczone dużymi dawkami dożylnych kortykosteroidów, stosowanymi przez krótki czas w celu złagodzenia poważnych objawów, takich jak utrata wzroku czy ekstremalna osłabienie.
Objawy nawrotu można również kontrolować poprzez fizjoterapię oraz wprowadzenie zmian w stylu życia, co pozwala pacjentom na kontynuowanie codziennych aktywności.
Wprowadzenie zdrowej diety, regularnych ćwiczeń oraz technik relaksacyjnych, takich jak medytacja czy głębokie oddychanie, może znacząco pomóc w radzeniu sobie z objawami RRMS.
Nowe Wnioski i Badania z 2024 Roku
W 2024 roku badania nad tumefaktywnym stwardnieniem rozsianym przyniosły nowe, obiecujące wyniki. Najnowsze analizy wskazują na związek między mikrobiomem jelitowym a przebiegiem SM. Badania sugerują, że odpowiednia flora bakteryjna może wpłynąć na nasilenie objawów choroby oraz skuteczność leczenia.
Dodatkowo, nowe metody obrazowania mózgu, takie jak zaawansowane techniki MRI, umożliwiają lepsze diagnozowanie tumefaktywnego SM poprzez dokładniejsze odzwierciedlenie zmian w tkankach mózgowych. Obserwacje te mogą prowadzić do szybszej i dokładniejszej diagnozy, co jest kluczowe dla skutecznego leczenia.
Inne badania koncentrują się na wpływie terapii biologicznych, które mogą okazać się skuteczne w redukcji częstości nawrotów oraz łagodzeniu objawów, co daje nadzieję na poprawę jakości życia pacjentów z tumefaktywnym SM.
Podsumowując, choć tumefaktywne SM jest poważnym wyzwaniem klinicznym, ciągły rozwój badań i terapii przynosi nowe nadzieje na skuteczniejsze leczenie tej choroby.








