Badania kliniczne są badaniami, których celem jest ustalenie, czy strategia medyczna, leczenie lub urządzenie są bezpieczne do użycia lub do spożycia przez ludzi.
Badania te mogą również oceniać skuteczność podejścia medycznego do określonych warunków lub grup ludzi.
Ogólnie rzecz biorąc, zwiększają wiedzę medyczną i zapewniają wiarygodne dane, które pomagają w podejmowaniu decyzji i wytycznych dotyczących opieki zdrowotnej.
Aby zapewnić bezpieczeństwo uczestników, należy rozpocząć badania od małych grup i zbadać, czy nowa metoda powoduje jakiekolwiek szkody lub niezadowalające skutki uboczne. Dzieje się tak dlatego, że technika, która jest skuteczna w laboratorium lub zwierzętach, może nie być bezpieczna lub skuteczna dla ludzi.
Szybkie fakty dotyczące badań klinicznych
- Badania kliniczne mają na celu sprawdzenie, czy strategia medyczna, leczenie lub urządzenie są bezpieczne i skuteczne, aby ludzie mogli je stosować lub konsumować.
- Próby składają się z czterech etapów i mogą skupić się na: leczeniu, zapobieganiu, diagnostyce, badaniach przesiewowych, opiece pomocniczej, badaniach w służbie zdrowia i podstawowej nauce.
- Zespół badawczy będzie prawdopodobnie obejmować lekarzy, pielęgniarki, pracowników socjalnych, pracowników służby zdrowia, naukowców, menedżerów danych i koordynatorów badań klinicznych.
- Uczestnictwo może wiązać się zarówno z ryzykiem, jak i korzyściami. Uczestnicy muszą przeczytać i podpisać dokument «świadomej zgody» przed przystąpieniem do procesu.
- Ryzyka są kontrolowane i monitorowane, ale natura badań medycznych oznacza, że niektóre zagrożenia są nieuniknione.
Czym są badania kliniczne?
Głównym celem badań klinicznych są badania. Próby mają na celu poszerzenie wiedzy medycznej związanej z leczeniem, diagnozowaniem i zapobieganiem chorobom lub stanom.

Badania prowadzone są zgodnie ze ścisłymi standardami naukowymi i wytycznymi, które mają na celu:
- chronić uczestników
- zapewniać rzetelne i dokładne wyniki
Badania kliniczne na ludziach odbywają się w końcowych etapach długiego, systematycznego i szczegółowego procesu badawczego.
Proces ten często rozpoczyna się w laboratorium, w którym opracowuje się i testuje nowe koncepcje.
Testowanie na zwierzętach umożliwia naukowcom sprawdzenie, w jaki sposób podejście wpływa na żywe ciało.
Wreszcie, testy na ludziach są przeprowadzane w małych, a następnie większych grupach.
Procesy mogą być przeprowadzane w celu:
- Ocenić jedną lub więcej interwencji terapeutycznych w przypadku choroby, zespołu lub stanu, takich jak leki, urządzenia medyczne lub podejścia do operacji lub terapii
- Oceń sposoby zapobiegania chorobie lub stanowi, na przykład poprzez leki, szczepionki i zmiany stylu życia
- Ocenić jedną lub więcej interwencji diagnostycznych, które mogą zidentyfikować lub zdiagnozować daną chorobę lub stan
- Zbadaj metody identyfikacji w celu rozpoznania warunku lub czynników ryzyka dla tego stanu
- Zapoznaj się z procedurami wsparcia wspierającego, aby poprawić komfort i jakość życia osób z przewlekłą chorobą
Wynik badania klinicznego może określić, czy nowa strategia medyczna, leczenie lub urządzenie:
- ma pozytywny wpływ na rokowanie pacjenta
- powoduje nieprzewidziane szkody
- nie ma żadnych pozytywnych korzyści lub ma negatywne skutki
Badania kliniczne mogą dostarczyć cennych informacji dotyczących opłacalności leczenia, wartości klinicznej testu diagnostycznego oraz tego, w jaki sposób leczenie poprawia jakość życia.
Rodzaje badań klinicznych
Wszystkie badania kliniczne mają główny cel. Można je podzielić na następujące kategorie:
- Leczenie: testowanie nowych terapii, nowych kombinacji leków lub nowych podejść do chirurgii lub terapii
- Zapobieganie: badanie sposobów poprawy zapobiegania lub nawrotu choroby poprzez, na przykład, leki, witaminy, szczepionki, minerały i zmiany stylu życia
- Diagnostyka: znajdowanie udoskonalonych technik testowania i procedur diagnozowania chorób i stanów
- Screening: Testowanie najlepszej metody identyfikacji określonych chorób lub stanów zdrowia
- Opieka wspomagająca: Badanie procedur mających na celu poprawę komfortu i jakości życia pacjentów z przewlekłą chorobą
- Badania w zakresie usług zdrowotnych: ocena dostarczania, przetwarzania, zarządzania, organizacji lub finansowania opieki zdrowotnej
- Podstawy nauki: Badanie działania interwencji
Dlaczego badania kliniczne są ważne?
Badania kliniczne pomagają usprawnić i przyspieszyć opiekę medyczną. Badania dostarczają faktycznych dowodów, które można wykorzystać w celu poprawy opieki nad pacjentem.
Badania kliniczne przeprowadza się tylko wtedy, gdy lekarze nie są świadomi takich elementów, jak:
- czy nowe podejście działa skutecznie u ludzi i jest bezpieczne
- jakie metody leczenia lub strategie działają z powodzeniem w przypadku niektórych chorób i grup osób
Jak działają badania kliniczne?
Różne elementy są zaangażowane w tworzenie, prowadzenie i prowadzenie badań klinicznych.
Protokół badań klinicznych

Proces jest zgodny z kompleksowym planem lub protokołem. Protokół jest pisemnym opisem badania klinicznego.
Obejmuje cele, projekt i metody badań, odpowiednie zaplecze naukowe i informacje statystyczne.
Kluczowymi informacjami, które należy uwzględnić, mogą być:
- liczba uczestników
- kto jest uprawniony do wzięcia udziału
- jakie testy zostaną przeprowadzone i jak często
- rodzaje danych, które należy zgromadzić
- długość badania
- szczegółowe informacje na temat planu leczenia
Unikanie uprzedzeń
Naukowcy muszą podjąć działania, aby uniknąć uprzedzeń.
Odchylenie odnosi się do ludzkich wyborów lub innych czynników, które nie są związane z protokołem, ale które mogą wpływać na wyniki próby.
Kroki, które mogą pomóc w uniknięciu błędu to grupy porównawcze, randomizacja i maskowanie.
Grupy porównawcze
W większości badań klinicznych stosuje się grupy porównawcze w celu porównania strategii medycznych i leczenia. Wyniki pokażą, czy jedna grupa ma lepszy wynik niż druga.
Zwykle odbywa się to na jeden z dwóch sposobów:
- Jedna grupa otrzymuje istniejące leczenie dla stanu, a druga grupa otrzymuje nowe leczenie. Badacze następnie porównują, która grupa ma lepsze wyniki.
- Jedna grupa otrzymuje nowe leczenie, a druga grupa otrzymuje placebo, nieaktywny produkt, który wygląda jak produkt testowy.
Randomizacja
W badaniach klinicznych z grupami porównawczymi często stosuje się randomizację. Uczestnicy są przydzielani do grup porównawczych przez przypadek, a nie przez wybór. Oznacza to, że wszelkie różnice zaobserwowane podczas badania wynikają z zastosowanej strategii, a nie z powodu wcześniej istniejących różnic między uczestnikami.
Maskowanie lub oślepianie
Maskowanie lub oślepianie pomaga uniknąć uprzedzeń, nie informując ani uczestników ani badaczy o tym, jakie leczenie uczestnicy będą otrzymywać.
Single blind: To jest, gdy albo uczestnicy albo badacze nie są świadomi, której grupy jest która.
Podwójna ślepota: wtedy zarówno uczestnicy, jak i badacze nie są świadomi.
Czynniki zakłócające
Czynnik zakłócający może zniekształcić prawdziwy związek między dwiema lub więcej cechami.
Na przykład można stwierdzić, że osoby noszące zapalniczkę są bardziej podatne na raka płuc, ponieważ niosący zapalniczkę powoduje raka płuc. W tym przykładzie palenie jest czynnikiem zakłócającym.
Ludzie, którzy noszą zapalniczkę, częściej palą, a palacze częściej chorują na raka płuc, ale niektórzy mogą mieć zapalniczkę do innych celów.
Nieuwzględnienie tego może prowadzić do fałszywych wniosków.
Kto jest w zespole badawczym?
Główny badacz, który zwykle jest lekarzem, poprowadzi każde badanie kliniczne.
Zespół badawczy może obejmować:
- lekarze
- pielęgniarki
- pracownicy socjalni
- pracownicy służby zdrowia
- naukowcy
- menedżerów danych
- koordynatorzy badań klinicznych
Gdzie prowadzone są badania kliniczne?
Lokalizacja zależeć będzie od rodzaju studiów i tego, kto je organizuje.
Niektóre typowe lokalizacje obejmują:
- szpitale
- uniwersytety
- centra medyczne
- gabinety lekarskie
- kliniki społeczności
- finansowane ze środków federalnych i finansowane przez przemysł witryny badawcze
Jak długo trwają testy?
To zależy od tego, co jest badane, między innymi. Niektóre próby trwają w ostatnich dniach, podczas gdy inne trwają latami.
Przed zapisaniem się na sesję uczestnicy dowiedzą się, jak długo ma trwać.
Zaprojektowany i zorganizowany
Istnieją różne rodzaje studiów i różne sposoby ich organizowania. Oto kilka rodzajów badań.
Badania obserwacyjne
Badania kohortowe i badania z kontrolą przypadku są przykładami badań obserwacyjnych.
Badanie kohortowe

Badanie kohortowe jest badaniem obserwacyjnym, w którym wybiera się populację badaną lub kohortę.
Zebrano informacje w celu ustalenia, które podmioty mają:
- szczególna cecha, taka jak grupa krwi, która jest uważana za powiązaną z rozwojem danej choroby
- narażenie na czynnik, który może być związany z chorobą, na przykład palenie papierosów
Osoba mogła zostać wybrana, ponieważ pali. Następnie mogą być śledzeni do przodu w czasie, aby zobaczyć, jak prawdopodobne jest, aby rozwinąć chorobę w porównaniu z innymi ludźmi.
Ten rodzaj badań jest wykorzystywany do badania wpływu podejrzanych czynników ryzyka, których nie można kontrolować eksperymentalnie, takich jak wpływ palenia na raka płuc.
Główne zalety badań kohortowych to:
- Ekspozycja jest mierzona przed pojawieniem się choroby, a zatem może być obiektywna pod względem rozwoju choroby.
- Rzadkie ekspozycje można badać poprzez odpowiedni dobór kohort badanych.
- Wiele wyników – lub chorób – można badać pod kątem każdej ekspozycji.
- Częstość występowania choroby można obliczyć zarówno w grupach narażonych, jak i nieeksponowanych.
Główne wady badań kohortowych to:
- Są one zazwyczaj drogie i czasochłonne, zwłaszcza jeśli są prowadzone prospektywnie, co oznacza posuwanie się naprzód.
- Zmiany zarówno statusu ekspozycji, jak i kryteriów diagnostycznych w czasie mogą wpływać na klasyfikację osób w zależności od ekspozycji i statusu choroby.
- W zakończonym wyniku może pojawić się błąd informacyjny, ponieważ znany jest stan ekspozycji pacjenta.
- Straty, które należy uzupełnić, mogą powodować uprzedzenia wyboru.
Studia kontroli przypadku
W badaniu kliniczno-kontrolnym można wyróżnić czynniki ryzyka dla konkretnego schorzenia.
Naukowcy porównują osoby z chorobą i osoby bez niej. Pracując wstecz w czasie, identyfikują, jak te dwie grupy się różnią.
Studia przypadku są zawsze retrospektywne – patrząc wstecz – ponieważ zaczynają się od wyniku, a następnie wracają, by zbadać ekspozycje.
Głównymi zaletami studiów przypadku są:
- Ustalenia można uzyskać szybko.
- Badanie może odbyć się przy minimum finansowania lub sponsoringu.
- Są skuteczne w badaniu rzadkich chorób lub chorób o długim okresie indukcji.
- Można zbadać szeroki zakres możliwych czynników ryzyka.
- Można badać wielokrotne ekspozycje.
- Wymagają niewielu przedmiotów do nauki.
Główne wady badań kontrolowanych przypadkami to:
- Nie można wygenerować danych o występowaniu.
- Są podatni na uprzedzenia.
- Uzyskanie dokładnych, obiektywnych mierników wcześniejszych zaangażowań może być trudne, jeśli prowadzenie dokumentacji jest niewystarczające lub niewiarygodne. Nazywa się to uprzedzeniem informacyjnym.
- Wybór elementów sterujących może być problematyczny. Może to wprowadzić błąd wyboru.
- Kolejność chronologiczna między narażeniem a chorobą może być trudna do zidentyfikowania.
- Nie są odpowiednie do badania rzadkich ekspozycji, chyba że ekspozycja odpowiada za duży odsetek przypadków.
Zagnieżdżone badanie kontroli przypadku
W zagnieżdżonym badaniu kliniczno-kontrolnym grupy – przypadki i kontrole – pochodzą z tej samej populacji lub kohorty.
Ponieważ kohorta jest kontynuowana, przypadki, które się pojawiają, stają się «przypadkami» w studium przypadku. Niekontrolowani uczestnicy kohorty stają się «kontrolami».
Zagnieżdżone badania kliniczno-kontrolne są mniej kosztowne i mniej czasochłonne w porównaniu z badaniem kohortowym.
Częstość występowania i częstość występowania choroby mogą czasami być rzutowane z zagnieżdżonego badania kohortowego z kontrolą przypadku. Nie jest to możliwe z prostego badania kontrolnego, ponieważ całkowita liczba narażonych osób i czasy obserwacji są zwykle nieznane.
Główne zalety zagnieżdżonych studiów przypadków to:
- Wydajność: Nie wszyscy uczestnicy badania wymagają testów diagnostycznych.
- Elastyczność: pozwalają na testowanie hipotez, które nie były przewidywane podczas planowania kohorty.
- Redukcja błędu selekcji: Przypadki i kontrole są próbkowane z tej samej populacji.
- Redukcja błędu informacyjnego: Ekspozycja na czynnik ryzyka może zostać oceniona, a badacz ślepy na przypadek.
Główną wadą jest to, że wyniki mają niższy autorytet, ze względu na mały rozmiar próbki.
Badania ekologiczne
Badanie ekologiczne analizuje zależność pomiędzy ekspozycją a wynikiem populacji lub społeczności.
Typowe kategorie badań ekologicznych obejmują:
- porównania geograficzne
- analiza trendów czasowych
- badania migracji
Główne zalety badań ekologicznych to:
- Są niedrogie, ponieważ można wykorzystać rutynowo zbierane dane dotyczące zdrowia.
- Są mniej czasochłonne niż inne badania.
- Są nieskomplikowane i łatwe do zrozumienia.
- Można zbadać wpływ ekspozycji mierzonych w grupach lub obszarach – takich jak dieta, zanieczyszczenie powietrza i temperatura.
Główne wady badań ekologicznych to:
- Mogą wystąpić błędy dedukcji, znane jako błąd ekologiczny. Dzieje się tak, gdy badacze wyciągają wnioski o osobach w oparciu wyłącznie o analizę danych grupowych.
- Narażenie na zależności wynikowe jest trudne do wykrycia.
- Brak jest informacji na temat czynników zakłócających.
- Mogą występować systematyczne różnice między obszarami pomiaru ekspozycji.
Badania eksperymentalne
Oprócz badań obserwacyjnych, istnieją również badania eksperymentalne, w tym badania dotyczące leczenia.
Randomizowane kontrolowane badania

Randomizowana kontrolowana próba (RCT) losowo przydziela osoby do otrzymania lub nieotrzymania konkretnej interwencji.
Zastosowana zostanie jedna z dwóch różnych metod leczenia lub leczenie i placebo.
Jest to najskuteczniejszy rodzaj badania, który pozwala określić, które leczenie działa najlepiej. Zmniejsza wpływ zmiennych zewnętrznych.
Główne zalety RCT to:
- Nie ma świadomego lub podświadomego nastawienia ze strony badacza. To zasadniczo gwarantuje zewnętrzną ważność.
- Zderzające się zmienne, takie jak wiek, płeć, waga, poziom aktywności itd., Mogą zostać anulowane, o ile grupa próbek jest wystarczająco duża.
Główne wady RCT to:
- Są czasochłonne.
- Mogą być drogie.
- Wymagają dużych grup próbek.
- Rzadkie zdarzenia mogą być trudne do zbadania.
- Możliwe są błędy statystyczne zarówno fałszywie dodatnie, jak i fałszywie ujemne.
Adaptacyjne badanie kliniczne
Metoda adaptacyjnego projektowania opiera się na zebranych danych. Jest elastyczny i wydajny. Modyfikacje można wprowadzić do badania i procedur statystycznych trwających badań klinicznych.
Quasi-eksperyment
Quasi-eksperymentalne lub «nierandomizowane» badania obejmują szeroki zakres badań interwencyjnych, które nie są randomizowane. Ten rodzaj badania jest często stosowany, gdy RCT nie jest logistycznie wykonalne lub etyczne.
Hierarchia dowodów
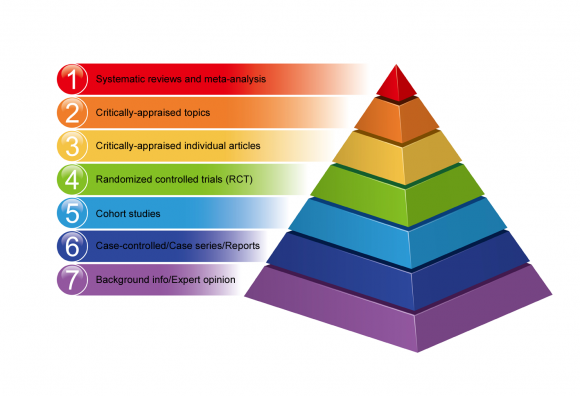
Hierarchia dowodów pozwala na uszeregowanie różnych metod badawczych zgodnie z ich wynikami.
Nie wszystkie projekty badawcze są równe pod względem ryzyka błędów i stronniczości w ich wynikach. Niektóre metody badań dostarczają lepszych dowodów niż inne.
Poniżej znajduje się przykład hierarchii medycyny opartej na dowodach w formie piramidy, począwszy od niższej jakości dowodów na dole po wysokiej jakości dowody na szczycie.
Fazy badań klinicznych
Badania medyczne są podzielone na różne etapy, zwane fazami. W przypadku testów narkotykowych są one określone przez FDA.
Próby wczesnej fazy badają bezpieczeństwo leku i jego działania niepożądane. Późniejsze próby sprawdzają, czy nowe leczenie jest lepsze niż istniejące leczenie.
Testy fazy 0: Farmakodynamika i farmakokinetyka
Faza 0 jest fazą eksploracyjną, która pomaga dostarczyć klinicznych informacji dla nowego leku we wcześniejszej fazie.
Ta faza:
- jest przeprowadzany na początku w fazie 1
- obejmuje bardzo ograniczone narażenie ludzi
- nie ma zamiaru terapeutycznego lub diagnostycznego, ogranicza się do badań przesiewowych i badania mikrodozą
Faza 1: Badania bezpieczeństwa
Po fazie 0 są cztery kolejne fazy prób u ludzi. Te często nakładają się. Fazy od 1 do 3 mają miejsce przed przyznaniem licencji.
Wytyczne dotyczące fazy 1 obejmują:
- od 20 do 80 zdrowych ochotników
- weryfikacja najczęstszych skutków ubocznych leku
- dowiedzieć się, jak lek jest metabolizowany i wydalany
Faza 2 próby: Stworzenie skuteczności
Jeżeli badania fazy 1 nie ujawnią niedopuszczalnych poziomów toksyczności, można rozpocząć badania fazy 2.
Wiąże:
- od 36 do 300 uczestników
- zebranie wstępnych danych na temat tego, czy lek działa u osób z pewną chorobą lub stanem
- kontrolowane próby, aby porównać osoby otrzymujące lek z osobami w podobnej sytuacji, które otrzymują inny lek lub placebo
- ciągła ocena bezpieczeństwa
- badania krótkoterminowych efektów ubocznych
Badania fazy 3: ostateczne potwierdzenie bezpieczeństwa i skuteczności
Jeśli faza 2 potwierdzi skuteczność leku, FDA i sponsorzy omówią, jak przeprowadzić badania na dużą skalę w fazie 3.
Będzie to obejmować:
- od 300 do 3000 uczestników
- gromadzenie dalszych informacji na temat bezpieczeństwa i skuteczności
- badania różnych populacji
- badanie różnych dawek w celu ustalenia najlepszej dawki recepty
- stosowanie leku w połączeniu z innymi lekami w celu określenia skuteczności
Po tej fazie kompletne informacje na temat nowego leku są przekazywane władzom służby zdrowia.
Spotkanie weryfikacyjne
Jeśli FDA zatwierdzi produkt do obrotu, przeprowadzane są badania po wprowadzeniu do obrotu i badania zaangażowania.
FDA wykorzystuje te badania w celu zebrania dalszych informacji dotyczących bezpieczeństwa, skuteczności lub optymalnego wykorzystania produktu.
Nowa aplikacja leku

Sponsor leków ukończy aplikację NDA (New Drug Application), aby poprosić FDA o rozważenie zatwierdzenia nowego leku do obrotu w USA.
NDA obejmuje:
- wszystkie dane dotyczące zwierząt i ludzi
- Analiza danych
- informacje dotyczące zachowań lekowych w ciele
- szczegóły dotyczące produkcji
FDA ma 60 dni na podjęcie decyzji, czy zgłosić ją do przeglądu.
Jeśli zdecydują się złożyć NDA, zespół ds. Przeglądu FDA jest odpowiedzialny za ocenę badań sponsora nad bezpieczeństwem i skutecznością leku.
Następnie należy wykonać następujące czynności.
Etykietowanie leków: FDA sprawdza profesjonalne etykietowanie leku i potwierdza, że odpowiednie informacje są przekazywane konsumentom i pracownikom służby zdrowia.
Inspekcja obiektu: FDA sprawdza obiekty, w których lek będzie produkowany.
Zatwierdzenie leku: recenzenci FDA zatwierdzają wniosek lub wydają list odpowiedzi.
Faza 4: badania podczas sprzedaży
Faza 4 ma miejsce po zatwierdzeniu leku do obrotu. Zostały zaprojektowane w taki sposób, aby obejmowały:
- ponad 1000 pacjentów
- kompleksowe doświadczenie w ocenie bezpieczeństwa i skuteczności nowego leku w większej grupie i subpopulacji pacjentów
- porównanie i połączenie z innymi dostępnymi metodami leczenia
- ocena długoterminowych skutków ubocznych leku
- wykrywanie mniej powszechnych zdarzeń niepożądanych
- opłacalność terapii lekowej w porównaniu z innymi tradycyjnymi i nowymi terapiami
Raport bezpieczeństwa
Po zatwierdzeniu leku przez FDA rozpoczyna się etap po wprowadzeniu leku do obrotu. Sponsor, zwykle producent, przekazuje FDA okresowe aktualizacje bezpieczeństwa.
Kto sponsoruje badania kliniczne?
Badania kliniczne i badania mogą kosztować setki milionów dolarów. Grupy, które finansują testy, mogą obejmować:
- firmy farmaceutyczne, biotechnologiczne i medyczne
- akademickie centra medyczne
- grupy wolontariuszy i fundacje
- Narodowy Instytut Zdrowia
- departamenty rządowe
- lekarze i dostawcy usług zdrowotnych
- osoby prywatne
Kto może wziąć udział?
Protokół określa, kto kwalifikuje się do udziału w procesie.
Możliwe kryteria włączenia mogą być następujące:
- o określonej chorobie lub stanie
- bycie «zdrowym», bez stanu zdrowia
Kryteria wykluczające to czynniki, które wykluczają niektórych ludzi z przystąpienia do procesu.
Przykłady obejmują wiek, płeć, specyficzny rodzaj lub stadium choroby, wcześniejszą historię leczenia i inne schorzenia.
Możliwe korzyści i zagrożenia
Udział w badaniach klinicznych może mieć zarówno korzyści, jak i ryzyko dla uczestników.
Możliwe korzyści z badań klinicznych obejmują:
- Uczestnicy mają dostęp do nowych metod leczenia.
- Jeśli leczenie okaże się skuteczne, uczestnicy będą jednymi z pierwszych, którzy skorzystają.
- Uczestnicy, którzy nie należą do grupy otrzymującej nowe leczenie, mogą otrzymać standardową terapię dla danego stanu, który może być równie dobry lub lepszy niż nowe podejście.
- Zdrowie jest ściśle monitorowane i wspierane przez zespół pracowników służby zdrowia.
- Informacje zebrane podczas badań klinicznych przyczyniają się do wiedzy naukowej, mogą pomagać innym i ostatecznie poprawiają opiekę zdrowotną.
Możliwe ryzyko to:
- Standardowa dbałość o konkretny stan może czasami być lepsza niż nowa strategia lub leczone terapie.
- Nowe podejście lub leczenie może działać dobrze dla niektórych uczestników, ale niekoniecznie dla innych.
- Mogą wystąpić nieoczekiwane lub nieprzewidziane skutki uboczne, szczególnie w badaniach fazy 1 i fazy 2 oraz z podejściami takimi jak terapia genowa lub nowe metody leczenia biologicznego.
- Ubezpieczenie zdrowotne i pracownicy służby zdrowia nie zawsze pokrywają koszty opieki nad pacjentami i koszty ponoszone przez osoby biorące udział w badaniach klinicznych.
Co oznacza udzielanie zgody?

Dokument świadomej zgody wyjaśnia ryzyko i potencjalne korzyści wynikające z udziału w badaniu klinicznym.
Elementy, które muszą pojawić się w dokumencie obejmują między innymi:
- cel badań
- przewidywalne ryzyko dyskomfortu
- możliwe korzyści
Uczestnicy powinni dokładnie zapoznać się z dokumentem zgody, zdecydować, czy chcą zapisać się i podpisać, zanim zostaną uwzględnieni w procesie.
Czy badania kliniczne są bezpieczne?
FDA stara się, aby każdy, kto rozważa przystąpienie do badania, miał dostęp do wszystkich wiarygodnych informacji, których potrzebuje, aby dokonać świadomego wyboru, w tym informacji o ryzyku.
Chociaż ryzyko dla uczestników jest kontrolowane i monitorowane, niektóre zagrożenia mogą być nieuniknione ze względu na charakter badań medycznych.
W jaki sposób uczestnicy są chronieni?

Bezpieczeństwo uczestników jest kwestią o wysokim priorytecie. W każdej próbie nadzór naukowy i prawa pacjenta przyczyniają się do ich ochrony.
Dobra praktyka kliniczna (GCP) ma na celu zapewnienie przestrzegania etycznych i odpowiednich procedur podczas prób.
Zgodność z GCP zapewnia społeczeństwu pewność, że bezpieczeństwo i prawa uczestników są chronione.
Ma na celu:
- w celu ochrony praw, bezpieczeństwa i dobra uczestników
- zagwarantowanie, że gromadzone dane są wiarygodne, spójne i mają odpowiednią jakość
- w celu zapewnienia wytycznych i standardów prowadzenia badań klinicznych
Podstawy GCP zostały opracowane po raz pierwszy w 1947 r. Główne punkty były takie, że podczas jakichkolwiek prób naukowcy muszą zagwarantować:
- dobrowolne uczestnictwo
- świadoma zgoda
- minimalizacja ryzyka
W miarę upływu czasu dodatki obejmowały od ustanowienia dodatkowej ochrony dla zagrożonych grup ludności, po udzielanie wskazówek organom prowadzącym badania.
Prawa pacjenta
Sposoby ochrony praw pacjenta obejmują:
Świadoma zgoda to proces dostarczania uczestnikom badań klinicznych wszystkich faktów dotyczących badania. Dzieje się tak, zanim uczestnicy zgodzą się wziąć udział i w trakcie procesu. Świadoma zgoda zawiera szczegółowe informacje na temat możliwych terapii i testów oraz możliwych korzyści i ryzyka.
Inne prawa: dokument świadomej zgody nie jest umową; uczestnicy mogą wycofać się z badania w dowolnym momencie, niezależnie od tego, czy badanie zostało zakończone, czy nie.
Prawa i ochrona dla dzieci: rodzic lub opiekun prawny musi wyrazić zgodę prawną, jeśli dziecko ma 18 lat lub jest młodsze. Jeśli badanie może wiązać się z ryzykiem większym niż minimalne, oboje rodzice muszą wyrazić zgodę. Dzieci w wieku powyżej 7 lat muszą wyrazić zgodę na udział w badaniach klinicznych.
Jak znaleźć badanie kliniczne?
Informacje na temat aktualnych badań klinicznych można znaleźć tutaj.
Nowe badania i dane na 2024 rok
W 2024 roku badania kliniczne zyskały na znaczeniu, zwłaszcza w kontekście nowych terapii genowych i immunoterapii, które obiecują skuteczniejsze leczenie nowotworów. Badania pokazują, że terapie te mogą poprawić przeżywalność pacjentów z zaawansowanymi nowotworami, dzięki czemu są one przedmiotem intensywnych badań klinicznych.
Wzrost liczby badań klinicznych dotyczących chorób rzadkich również zyskuje na znaczeniu. W 2024 roku wiele firm farmaceutycznych rozpoczęło programy mające na celu lepsze zrozumienie i leczenie tych schorzeń, co może prowadzić do nowych możliwości terapeutycznych dla pacjentów.
Dane z ostatnich badań sugerują, że uczestnictwo w badaniach klinicznych nie tylko przyczynia się do rozwoju nauki, ale również pozytywnie wpływa na zdrowie psychiczne uczestników, którzy czują, że przyczyniają się do walki z chorobami.
Warto również zauważyć, że w 2024 roku zwiększa się nacisk na etykę i bezpieczeństwo uczestników badań. Wiele instytucji badawczych wprowadza nowe standardy ochrony praw pacjentów, co przekłada się na większe zaufanie do badań klinicznych.








